2as SÉRIES C e D - QUIMICA - PROF WELLINGTON
1-Relacione
as colunas abaixo e indique quais são as principais forças intermoleculares
(coluna I) que ocorrem entre as moléculas das substâncias moleculares listadas
na coluna II.
Coluna I:
I-
Ligação de hidrogênio;
II-
Interação dipolo-dipolo;
III-
Interação dipolo induzido-dipolo induzido.
Coluna II:
a) Amônia (NH3).
b) Água (H2O).
c) Acetaldeído (CH2O).
d) Bromo (Br2).
e) Cianeto de hidrogênio
(HCN).
2-O
gás presente nas bebidas gaseificadas é o dióxido de carbono (CO2). O aumento
da pressão e o abaixamento da temperatura facilitam a dissolução do dióxido de
carbono em água. Que tipo de interação intermolecular ocorre entre as moléculas
de dióxido de carbono, entre as moléculas de água e entre as moléculas de
dióxido de carbono e água, respectivamente?
a)
Nos três casos ocorrem interações do tipo dipolo induzido-dipolo induzido.
b)
dipolo induzido-dipolo induzido, ligações de hidrogênio, dipolo-dipolo
induzido.
c)
ligações de hidrogênio, ligações de hidrogênio, dipolo induzido-dipolo
induzido.
d)
ligações de hidrogênio, dipolo induzido-dipolo induzido, dipolo-dipolo
induzido.
e)
dipolo induzido-dipolo induzido, ligações de hidrogênio, ligações de
hidrogênio.
3-O
conhecimento das estruturas das moléculas é um assunto bastante relevante, já
que as formas das moléculas determinam propriedades das substâncias como odor,
sabor, coloração e solubilidade. As figuras apresentam as estruturas das
moléculas de CO2,
H2O, NH3, CH4, H2S e PH3.
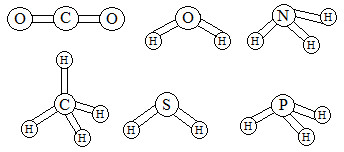 Estruturas de moléculas em exercícios sobre interações intermoleculares
Quanto
às forças intermoleculares, a molécula que forma ligações de hidrogênio (pontes
de hidrogênio) com a água é:
Estruturas de moléculas em exercícios sobre interações intermoleculares
Quanto
às forças intermoleculares, a molécula que forma ligações de hidrogênio (pontes
de hidrogênio) com a água é:
a)
H2S.
b)
CH4.
c)
NH3.
d)
PH3.
e)
CO2.
4-A
água, ao solidificar, aumenta de volume e, em consequência, a densidade do gelo
é inferior a da água. O fenômeno pode ser explicado pela estrutura do gelo, com
base em ligações
a)
iônicas.
b)
covalentes.
c)
por força de Van Der Waals.
d)
por pontes de hidrogênio.
e)
metálicas.

5-A pele humana, quando está bem hidratada,
adquire boa elasticidade e aspecto macio e suave. Em contrapartida, quando está
ressecada, perde sua elasticidade e se apresenta opaca e áspera. Para evitar o
ressecamento da pele é necessário, sempre que possível, utilizar hidratantes
umectantes, feitos geralmente à base de glicerina e polietilenoglicol:
A retenção de água na superfície da pele promovida pelos hidratantes é consequência da interação dos grupos hidroxila dos agentes umectantes com a umidade contida no ambiente por meio de
a)
Ligações iônicas.
b)
Forças de London.
c)
Ligações covalentes.
d)
Forças dipolo-dipolo.
e)
Ligações de hidrogênio.
6-Determine
se as ligações a seguir são polares ou apolares e especifique também se são
iônicas ou covalentes:
a)
H2
b)
HCl
c)
Cl2
d)
CO2
e)
NH3
7-Na
escala de eletronegatividade, tem-se:
Li
H
Br
N O
1,0
2,1 2,8
3,0 3,5
Esses dados permitem
afirmar que, entre as moléculas a seguir, a mais polar é:
a)
O2 (g)
b)
LiBr (g)
c)
NO (g)
d)
HBr (g)
e)
Li2 (g)
8-Dentre
as substâncias representadas abaixo, assinale a que é constituída de moléculas
polares:
a) CO2
b) H2O
c) BF3
d) Cl2
e) CCl4
9-Analise as proposições abaixo.
I. Os átomos que possuem 8 elétrons na camada de
valência são estáveis quimicamente.
II. As ligações iônicas características ocorrem entre
elementos que possuem uma pequena ou nenhuma diferença de eletronegatividade.
III. As ligações covalentes ocorrem através do
compartilhamento de pares de elétrons.
IV. As ligações covalentes resultam de forças de
atração opostas, produzindo substâncias sólidas com alto ponto de fusão.
V. Estudos têm demonstrado que toda ligação iônica tem
um grau de ligação covalente ou de ligação metálica.
Assinale a alternativa correta.
a) Somente as afirmativas IV e V são verdadeiras.
b) Somente as afirmativas I, II e III são verdadeiras.
c) Somente as afirmativas I, III e V são verdadeiras.
d) Somente as afirmativas II e V são verdadeiras.
e)
Somente as afirmativas I, III e IV são verdadeiras.
10-Analise
as seguintes informações:
I.
A molécula CO2 é apolar, sendo formada por ligações covalentes polares.
II. A molécula H2O é polar,
sendo formada por ligaçõescovalentes apolares.
III. A molécula NH3é polar,
sendo formada por ligações iônicas.
Concluiu-se que:
a) somente I é correta.
b) somente II é correta.
c) somente III é correta.
d) somente II e III são
corretas.
e) somente I e III são
corretas.

